韦翰斯产品推送 | WES联合CNV-seq技术
发布日期:2022-10-11
近年来,各种基因检测技术包括单基因测序、基因Panel、全外显子组测序和全基因组测序等被广泛应用于人类不同系统遗传病的诊断中。基因检测技术的快速发展使临床医生能够探索表型更为复杂、遗传异质性更大的疾病,帮助他们对疾病作出快速且精准的诊断。
各种新兴基因检测技术帮助临床医生发现和识别大量与各个系统遗传病相关的致病基因和表型,提高了人们对遗传病的认识,使临床诊断变得更加高效和精准。由于遗传病的变异类型复杂多样(SNV、InDel、CNV、LOH、甲基化异常、印记基因异常等),因此在遗传病诊断中合理应用基因检测显得尤为重要。
韦翰斯全外显子测序技术依托新一代高通量基因测序仪,采用全外显子组基因测序(whole exome sequencing, WES)及基因组拷贝数变异测序(Copy number variation sequencing,CNV-seq)联合检测策略,一次性对单基因遗传病及染色体病进行全面检测,全面排查儿童智力障碍、发育迟缓及孕妇反复流产、不孕不育的原因,为疾病的分子诊断提供全面、准确、科学的指导。
WES+CNV-seq 临床应用


CNV-seq和WES联合检测模式有助于胎儿异常的诊断,提高诊断率
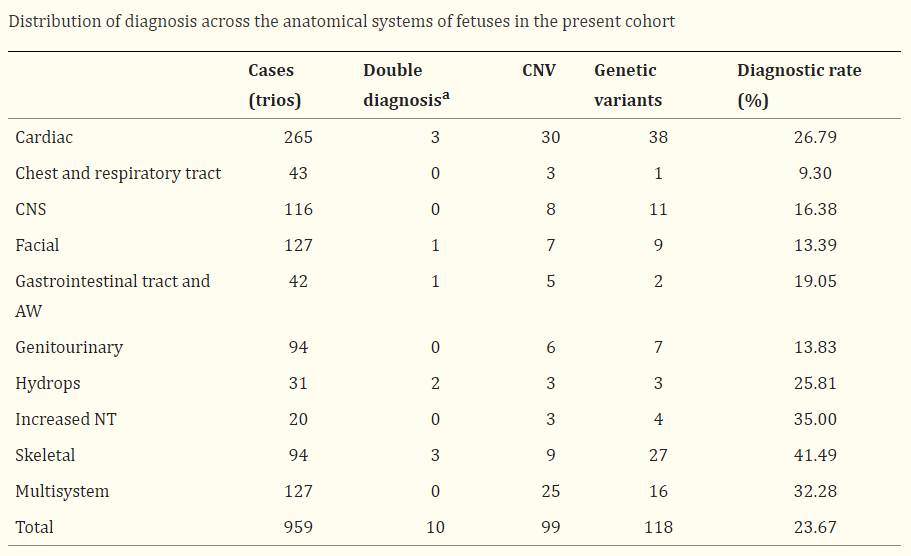
WES+CNV-seq的检测策略除了可以对神经系统疾病(NDs)、胎儿超声结构性异常等进行检测外,也可以应用于任何系统异常的单基因遗传病。
全外+CNV-seq检测内容
不同检测技术分析CNV的区别

韦翰斯Trio-(WES+CNV-seq)检测内容
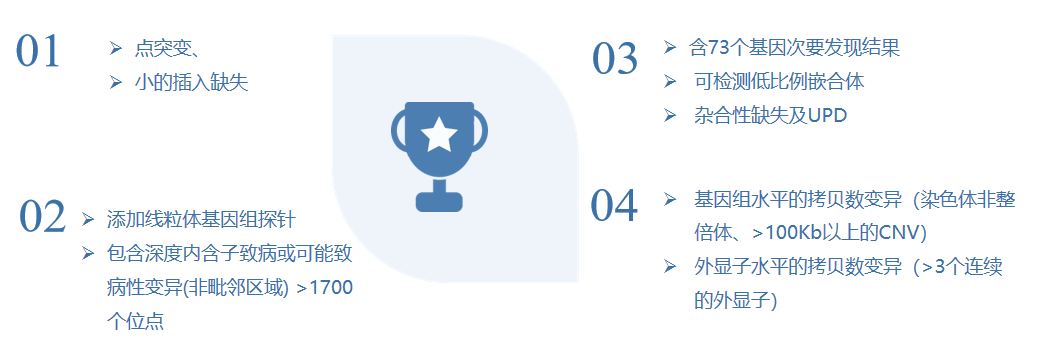
家系检测模式优势
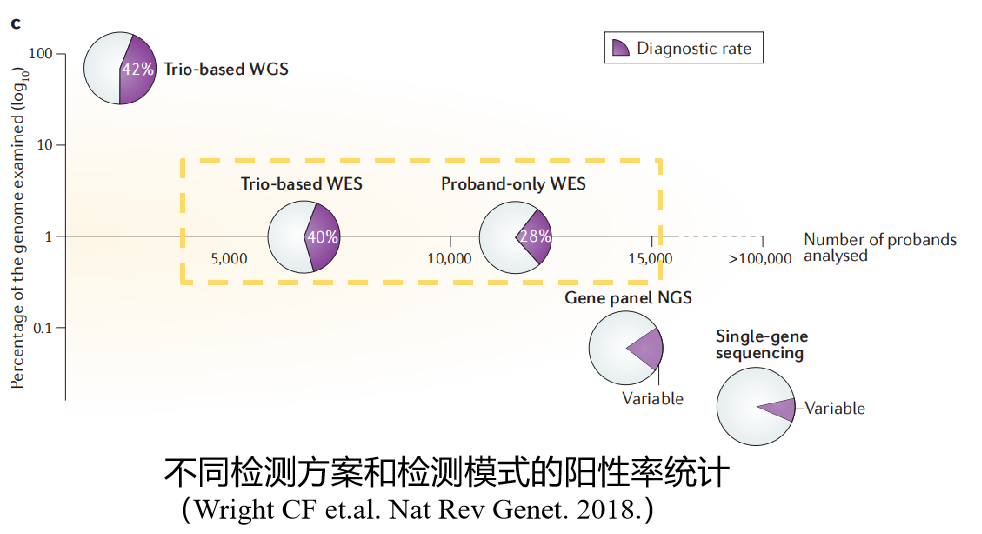
Trio -(WES+CNV-seq)联合优势
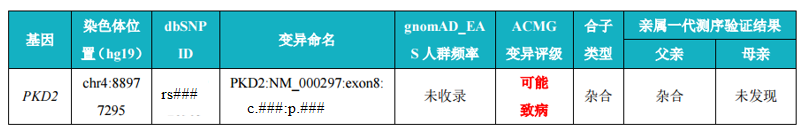
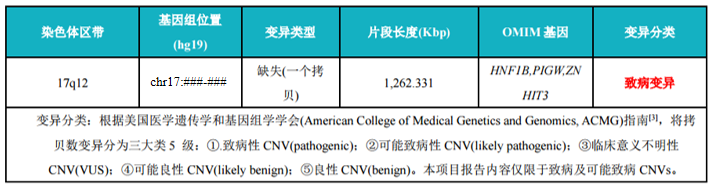
WES+CNV-seq 联合——韦翰斯案例